Configurazione elettronica degli elementi – Chimica
La configurazione elettronica di un elemento e come riempire gli orbitali.
Per configurazione elettronica di un elemento si intende la disposizione degli elettroni nei suoi orbitali.
Definizione di orbitale
Secondo il modello atomico di Schrodinger un orbitale definisce una regione dello spazio in cui è massima la probabilità di trovare l’elettrone.
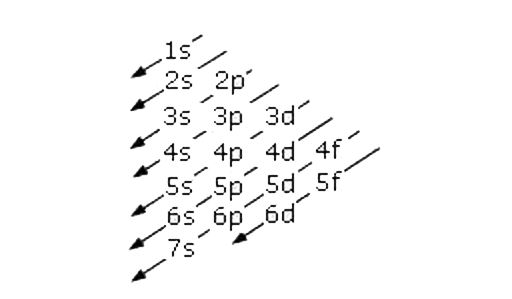
Configurazione elettronica degli elementi – Chimica
A ciascun orbitale viene associata una sigla composta da un numero e da una lettera. Il numero rappresenta il numero quantico principale e può assumere valori interi tra 1 e 7. La lettera (s, p, d, f) rappresenta il numero quantico secondario. Il numero quantico principale si indica con n rappresenta il livello energetico e la dimensione degli orbitali. Il numero quantico secondario si indica con l e rappresenta la forma dell’ orbitale.
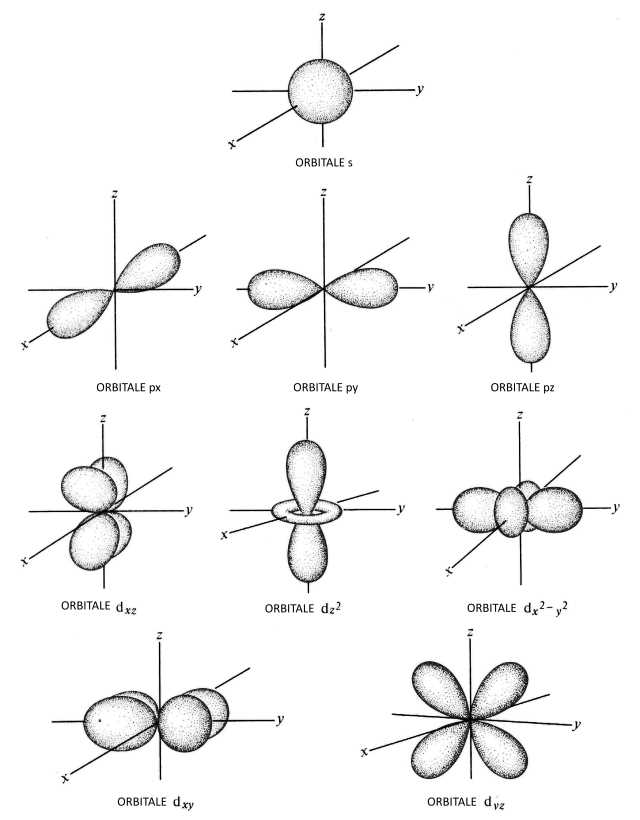
Orbitali elettronici – Chimica
Come scrivere la configurazione elettronica di un elemento
Viene rappresentata graficamente attraverso dei quadratini da riempire con tutti gli elettroni dell’elemento.
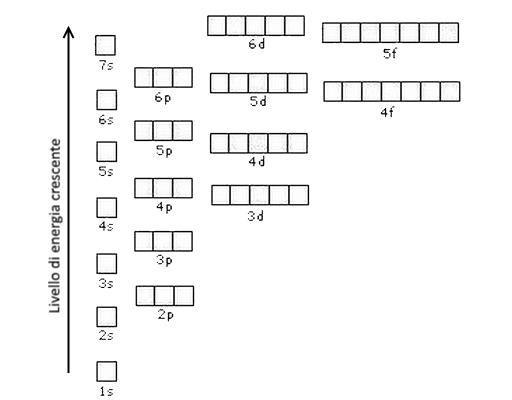
Configurazione elettronica – Rappresenzaione grafica
Occorre essenzialmente seguire tre regole:
- Principio della costruzione progressiva: si occupano prima gli orbitali a più bassa energia e poi quelli a energia più elevata.
- Principio di esclusione di Pauli: ogni orbitale può contenere al massimo due elettroni e di spin opposto.
- Regole di Hund: negli orbitali aventi stessa energia (degeneri) si colloca un elettrone su ciascun orbitale e poi si completano gli orbitali semipieni.
Esempio
Configurazione elettronica dell’ossigeno (numero atomico Z = 8):
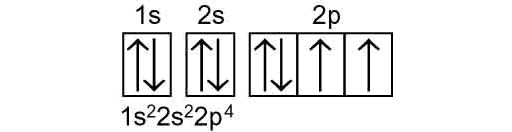
Configurazione elettronica dell’ Ossigeno – Chimica
Si riempiono dal livello piu basso di energia 1s² 2s² 2p4, prima mettendo gli elettroni in ciascun orbitale tipo p con stesso spin (freccia) e poi riempendo gli altri. Cosi si spiega anche la valenza o numero di ossidazione dell’ossigeno (-2): gli ultimi due “posti” appunto possono essere riempiti con altri 2 elettroni di altri atomi, tendendo alla configurazione del gas nobile del corrispondente periodo.
Link utili:
- Configurazione elettronica (wikipedia)
- Orbitale atomico (wikipedia)
- Spin elettronico (wikipedia)









